-
EBAU Andalucía: química (junio 2024) - ejercicio C.2 (8273)
Para preparar 250 mL de disolución saturada de 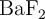 a
a 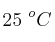 se necesitan 325 mg de dicho compuesto.
se necesitan 325 mg de dicho compuesto.
a) A partir del equilibrio correspondiente, calcula el producto de solubilidad del 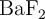 .
.
b) Calcula la solubilidad molar del 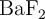 en presencia de NaF 0.50 M.
en presencia de NaF 0.50 M.
Masas atómicas relativas: F= 19 ; Ba= 137.3
-
EBAU Andalucía: química (junio 2024) - ejercicio C.1 (8271)
El 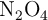 se descompone en
se descompone en 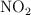 , estableciéndose el siguiente equilibrio:
, estableciéndose el siguiente equilibrio:

En un recipiente de 0.5 L se introducen 0.025 moles de 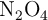 a
a 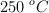 . Una vez alcanzado el equilibrio, la presión total es de 3.86 atm. Calcula:
. Una vez alcanzado el equilibrio, la presión total es de 3.86 atm. Calcula:
a) La presión parcial de cada gas en el equilibrio y el valor de  a la temperatura dada.
a la temperatura dada.
b) El grado de disociación del 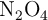 y el valor de
y el valor de  a la temperatura dada.
a la temperatura dada.
Dato: 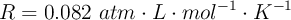
-
EBAU Andalucía: química (junio 2024) - ejercicio B.2 (8258)
El metanol se prepara industrialmente según el proceso siguiente:
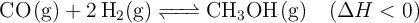
Razona cómo afectaría al rendimiento de la reacción:
a) Aumentar la temperatura.
b) Retirar del reactor el 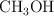 a medida que se vaya produciendo.
a medida que se vaya produciendo.
c) Aumentar la presión del sistema a temperatura constante.
-
EBAU Andalucía: química (junio 2024) RESERVA - ejercicio C.1 (8242)
Se introducen 2 g de 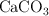 en un recipiente de 2 L y se calienta a
en un recipiente de 2 L y se calienta a 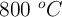 estableciéndose el siguiente equilibrio:
estableciéndose el siguiente equilibrio:
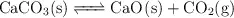
Calcula:
a) Las constantes  y
y  a esa temperatura si la presión en el equilibrio es de 0.236 atm.
a esa temperatura si la presión en el equilibrio es de 0.236 atm.
b) Los gramos de 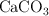 y de
y de 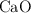 que hay en el recipiente después de que se alcance el equilibrio.
que hay en el recipiente después de que se alcance el equilibrio.
Datos: Ca = 40 ; O = 16 ; C = 12 ; 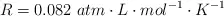
-
EBAU Andalucía: química (junio 2024) RESERVA - ejercicio B.6 (8241)
Al añadir una pequeña cantidad de 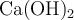 sólido a un vaso con agua se observa que no se disuelve por completo, quedando parte del sólido en equilibrio con la disolución saturada.
sólido a un vaso con agua se observa que no se disuelve por completo, quedando parte del sólido en equilibrio con la disolución saturada.
a) A partir del equilibrio correspondiente, deduce la relación entre la solubilidad molar de este compuesto y su producto de solubilidad.
b) Razona si aumentará la solubilidad del 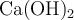 añadiendo a la disolución
añadiendo a la disolución 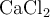 , que es una sal muy soluble.
, que es una sal muy soluble.
c) Justifica si cambiará el producto de solubilidad del 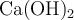 al añadir NaOH a la disolución saturada.
al añadir NaOH a la disolución saturada.