Métodos de separación de mezclas
Mezclas heterogéneas
A continuación, vas a estudiar distintos métodos de separación para mezclas heterogéneas. Con el fin de comprender el método más adecuado para cada tipo de mezcla, vamos a clasificar estos métodos en grupos.
Separación de mezclas sólido-sólido
A partir de alguna propiedad específica de algunos de los componentes de la mezcla podemos hacer la separación de esos componentes de manera efectiva.
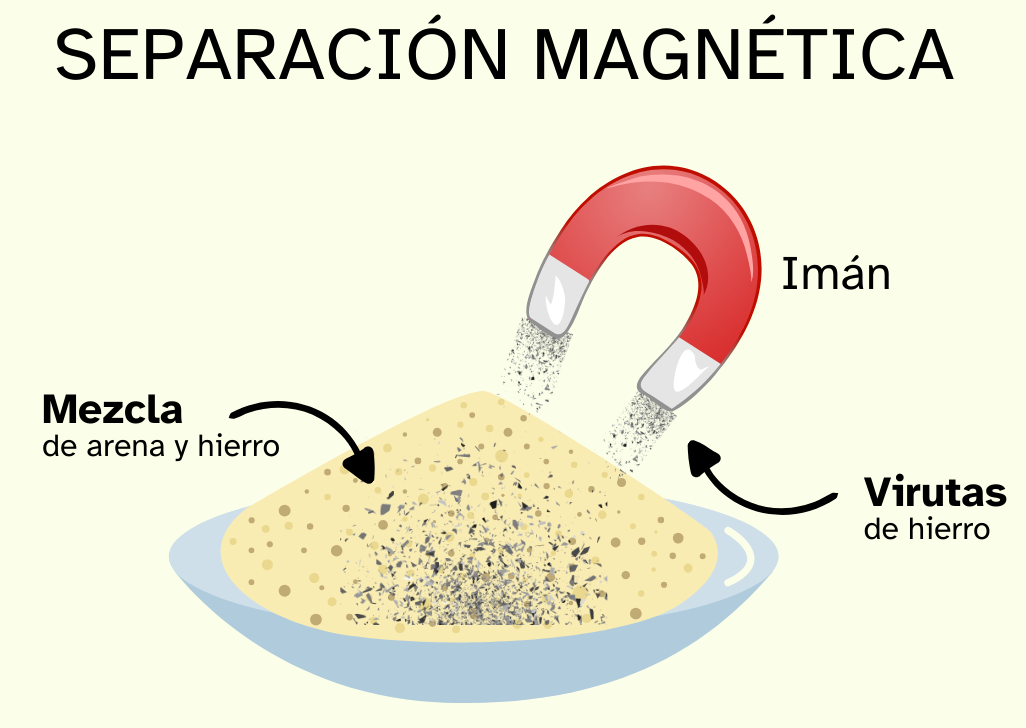
Separación magnética
Si uno de los componentes es magnético, podemos usar un imán para separarlo del resto de los componentes de la mezcla. Si el sólido magnético está en una mezcla líquida también es posible separarlo por medio de este método.
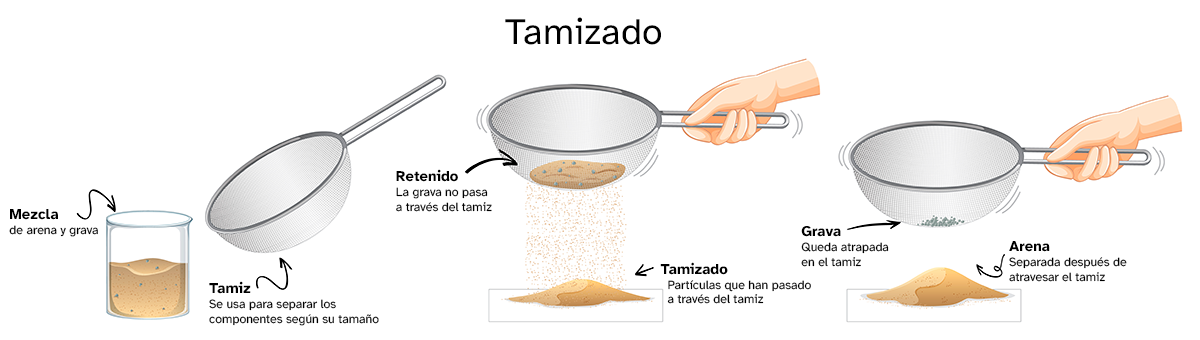
Tamizado
Usando un tamiz, o un colador, podemos separar el componente que queramos de la mezcla en función del tamaño de los componentes. Para ello habrá que elegir bien el tamaño de la malla que vayamos a usar. Este método también se puede usar para separar sólidos en mezclas sólido-líquido.
Sublimación
Si uno de los componentes sublima al calentarlo brevemente, podremos separarlo de la mezcla.
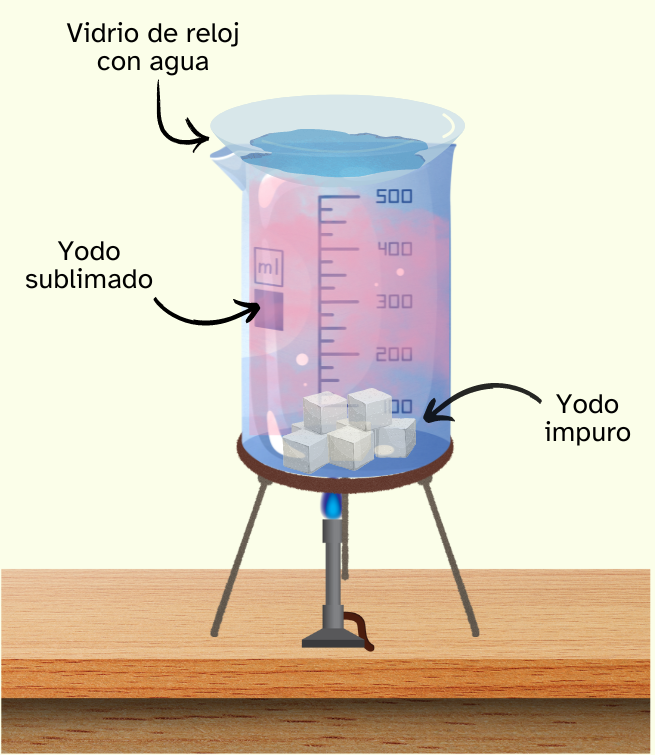
A continuación, puedes ver este magnífico vídeo en el que se hace la separación del yodo en arena, usando la técnica de la sublimación.
Es el cambio de estado de sólido a gas, sin pasar por el estado de agregación líquido.
Separación de mezclas sólido-líquido
Para que sean heterogéneas, es necesario que haya dos fases en este tipo de mezclas.
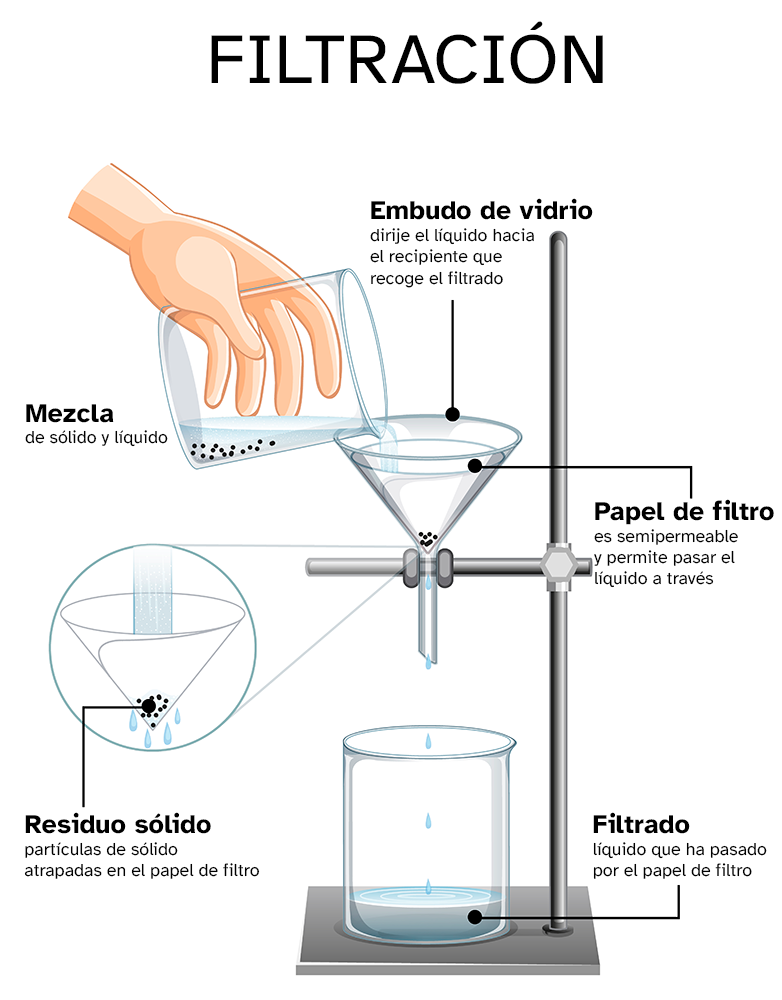
Filtración
Este método es adecuado solo si el sólido es insoluble en la fase líquida, por lo que habrá dos fases.
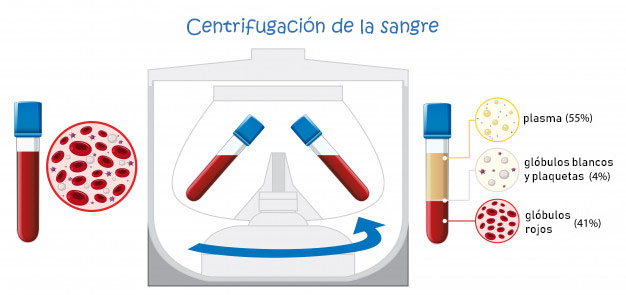
Centrifugación
En el caso de las suspensiones, es decir, partículas muy pequeñas de sólido que están suspendidas en una fase líquida, podemos forzar la sedimentación de la fase sólida si centrifugamos la mezcla. Después del centrifugado, las partículas más pesadas se encontrarán pegadas al fondo del tubo.
En este enlace puedes ver un vídeo en el que explica cómo hacer una centrifugado y posterior decantación.
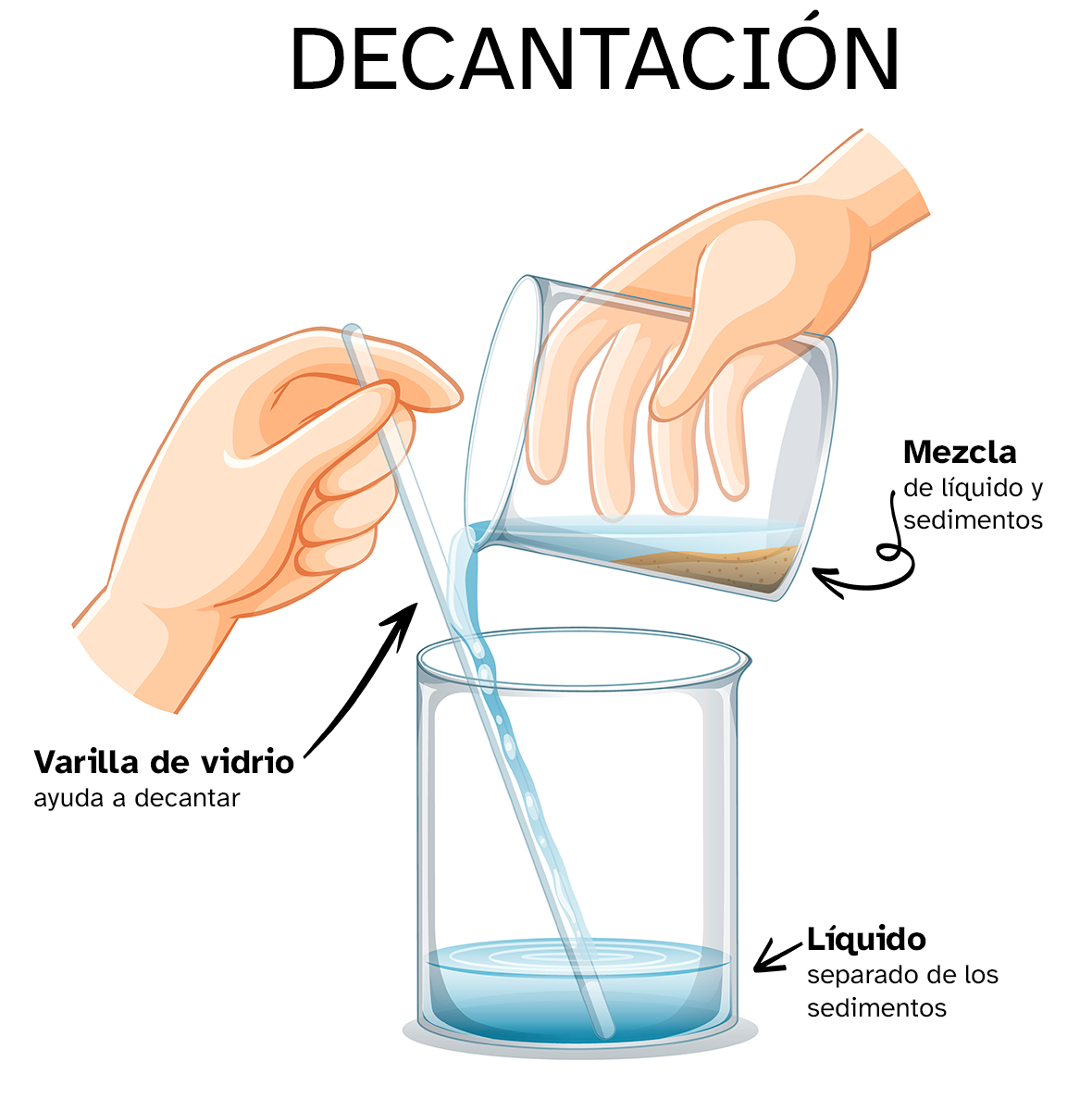
Decantación
Cuando tienes una fase sólida en el fondo de una muestra, como después de una sedimentación o centrifugación, puedes separar el sobrenadante y el sedimento por decantación o filtración. Hay dos formas de separar las fases, por filtración (que has visto antes) o por decantación (como has visto en el vídeo anterior) e ilustra esta imagen:
Tipo de mezcla heterogénea en la que las partículas de la fase suspendida son muy pequeñas. Recuerda el ejemplo del Cola Cao.
Parte superior después de separar la muestra por centrifugación y que es líquida.
Hace referencia a la parte sólida que queda al fondo después de centrifugar la muestra.
Es un tipo de mezcla heterogénea en la que las partículas de la fase suspendida son muy pequeñas. Recuerda el ejemplo del ®ColaCao.
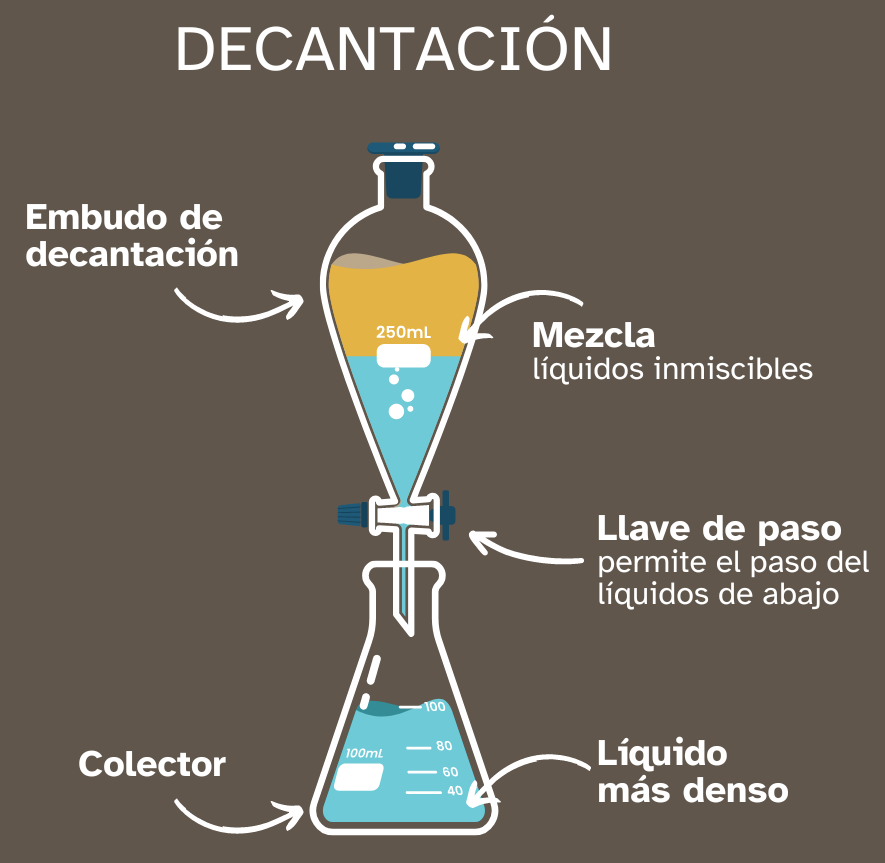
Separación de mezclas líquido-líquido
Si tenemos una mezcla de líquidos inmiscibles, podemos separarlos usando un embudo de decantación, una vez que los líquidos se han ordenado según sus densidades, el de mayor densidad en la parte de abajo y el de menor densidad en la parte superior de la mezcla.
|
Como puedes ver, si mezclamos aceite y agua, siendo ambos líquidos inmiscibles, van a fijar su posición en función de sus densidades: en la parte superior se colocará el aceite por tener menor densidad. Podemos separar ambos líquidos usando el embudo de decantación. El primer líquido que será separado será el de mayor densidad porque es el que está colocado en la parte inferior. Al abrir la llave de paso irá goteando el agua hasta que se haya separado completamente de la mezcla. |
Inmiscible es lo mismo que decir que no se pueden mezclar. Líquidos inmiscibles son, por lo tanto, líquidos que no se pueden mezclar entre sí.
Mezclas homogéneas
En este apartado vas a aprender métodos para separar los componentes de mezclas homogéneas, es decir, mezclas en las que no puedes distinguir los componentes. Es lo mismo que decir que son mezclas que solo presentan una fase.
Separación de mezclas sólido-líquido
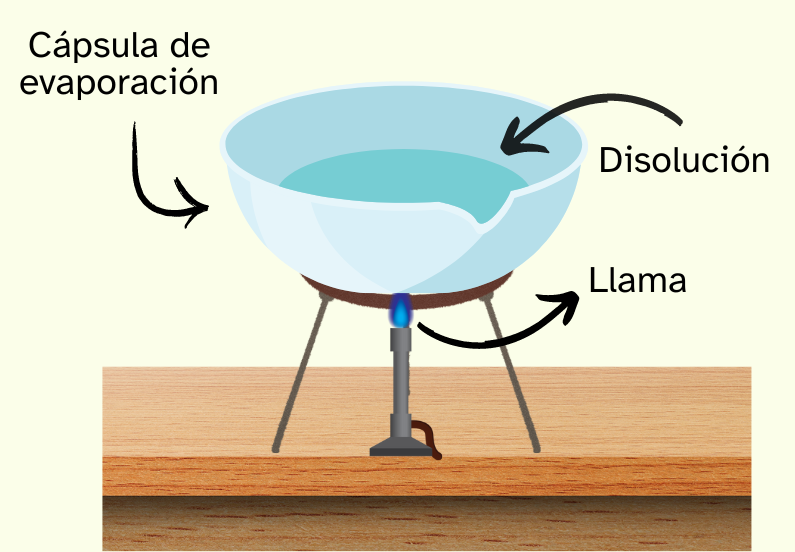
Evaporación
|
Este método se usa para separar un soluto sólido de un disolvente líquido, que suele ser agua en la mayoría de los casos. Se trata de esperar hasta que el disolvente se haya evaporado completamente de la disolución. Es posible acelerar la evaporación si se calienta la mezcla. El disolvente no puede recuperarse con este método. |
Cristalización
|
Es un método usado para purificar sólidos. Si disolvemos un soluto con impurezas en un disolvente, podemos obtener el soluto purificado siguiendo estos pasos:
|
En este vídeo puedes ver cómo se forman cristales cada vez más grandes con este proceso.
Separación de mezclas homogéneas líquido-líquido
Extracción
Este método se usa para separar una sustancia disuelta en un disolución usando otro disolvente que es inmiscible con la mezcla pero en el que la solubilidad de la sustancia a separar es mejor.
| La imagen de la derecha está referida a la extracción de la cafeína del café. La cafeína está disuelta en el agua porque el agua es el disolvente del café, que es una disolución. Si ponemos en contacto el café con un disolvente orgánico llamado diclorometano (DCM), la cafeína irá pasando desde el agua hasta el DCM. Esto se produce porque la cafeína es un compuesto orgánico y tiene una polaridad similar a la del DCM, haciendo que su solubilidad sea mejor. |
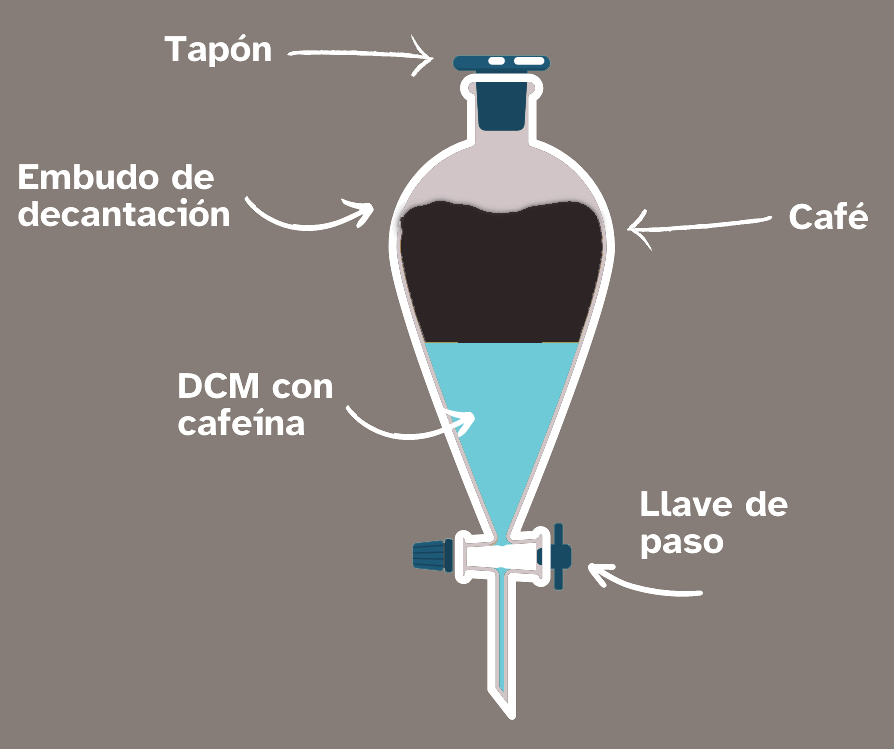
|
Es una droga excitante que contiene el café, el té, el chocolate o las mal llamadas «bebidas energéticas».
Disolvente orgánico en el que las sustancias orgánicas, como la cafeína, se disuelven mejor que en el agua.
Cromatografía simple
La cromatografía se puede usar para separar mezclas de compuestos coloreados. Las mezclas adecuadas para la separación por medio de esta técnica pueden ser tintas, tintes y colorantes alimentarios. Solo vamos a estudiar la cromatografía en papel o simple. Consideramos dos fases en esta técnica; la fase estacionaria (papel) y la fase móvil
(eluido). Llamamos eluente al disolvente que transporta el analito.
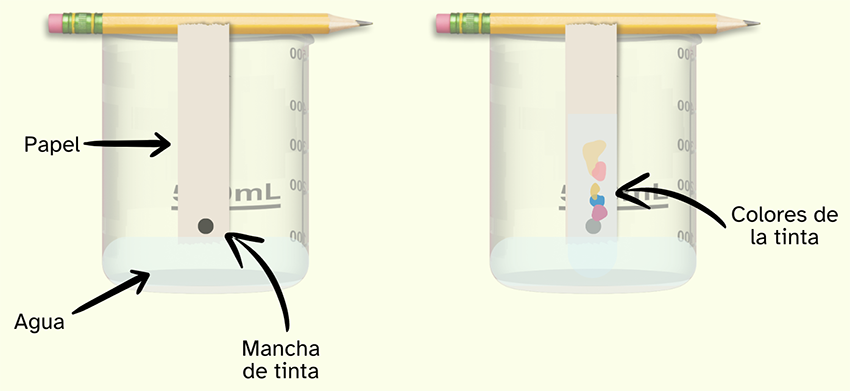
|
Esta técnica se puede hace si pintas un punto grueso de tinta en una tira de papel de filtro. El papel se coloca en el fondo del recipiente que contiene una pequeña cantidad de disolvente polar (agua o alcohol). En cuanto el disolvente comienza a ascender por el papel de filtro (el efecto se llama capilaridad), se encuentra con la mezcla de pigmentos que es la tinta que has puesto en el papel y esa mezcla comienza a ascender por el papel junto con el disolvente. Como el papel está hecho de celulosa, que es una sustancia polar, los componentes de la tinta serán capaces de desplazarse más lejos cuanto menos polares sean. Los componentes más polares se unirán más a la celulosa y quedarán más cerca del líquido que los que son menos polares. |
Es el disolvente que asciende por el papel en este tipo de técnica y que contiene disueltas las sustancias que queremos separar.
Hace referencia solo al disolvente que empleamos, por ejemplo, alcohol.
Es el conjunto de sustancias que van disueltas en el eluente y que queremos separar. La suma del analito y el eluente es el eluido.
Destilación
Esta técnica es muy útil cuando tenemos una mezcla de líquidos miscibles con puntos de ebullición distintos. Es muy importante estar atento a la temperatura de la mezcla cuando la destilación comienza. Esta magnitud nos da información sobre la evolución de la separación de los componentes de la mezcla. A continuación, tienes un ejemplo de la destilación de una mezcla formada por agua y alcohol etílico (etanol).
| Ponemos la mezcla de agua y etanol en el matraz y comenzamos a calentarla. La temperatura comenzará a aumentar lentamente. Hay que prestar atención al termómetro porque a los 78 ºC la temperatura dejará de aumentar. Ese valor de temperatura es el punto de ebullición del etanol. |
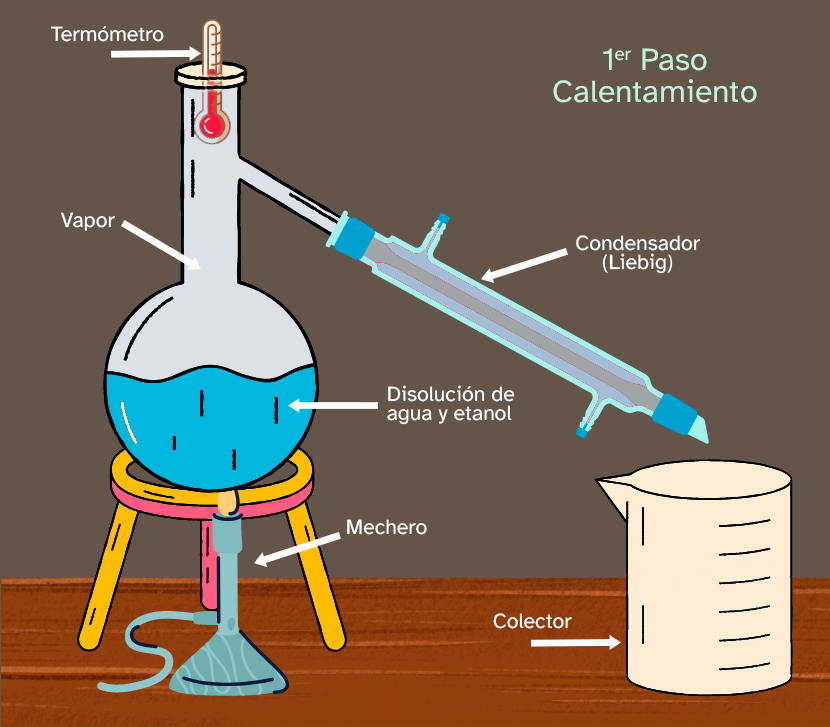
|
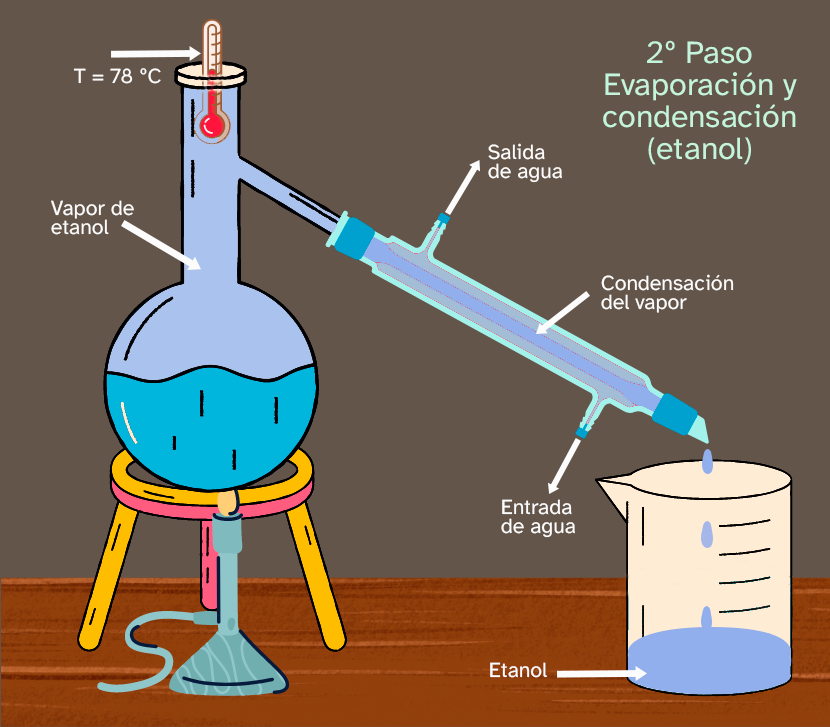
|
Como puedes ver en la imagen, en ese momento el etanol está cambiando de estado de líquido a vapor. Mientras haya algo de etanol en estado líquido, la temperatura va a seguir siendo constante. El vapor de etanol puro se condensa en el condensador (condensador Liebig en la imagen) y está goteando dentro del vaso de precipitados o colector, en forma de etanol líquido puro. |
| Cuando la temperatura comience a subir otra vez, todo el etanol de la mezcla habrá sido separado y, en ese momento, debemos usar otro vaso de precipitados vacío para empezar a recoger el agua pura que se formará cuando el vapor pase a través del condensador Liebig. Como puedes ver, la temperatura es ahora 100 ºC, el punto de ebullición del agua. |
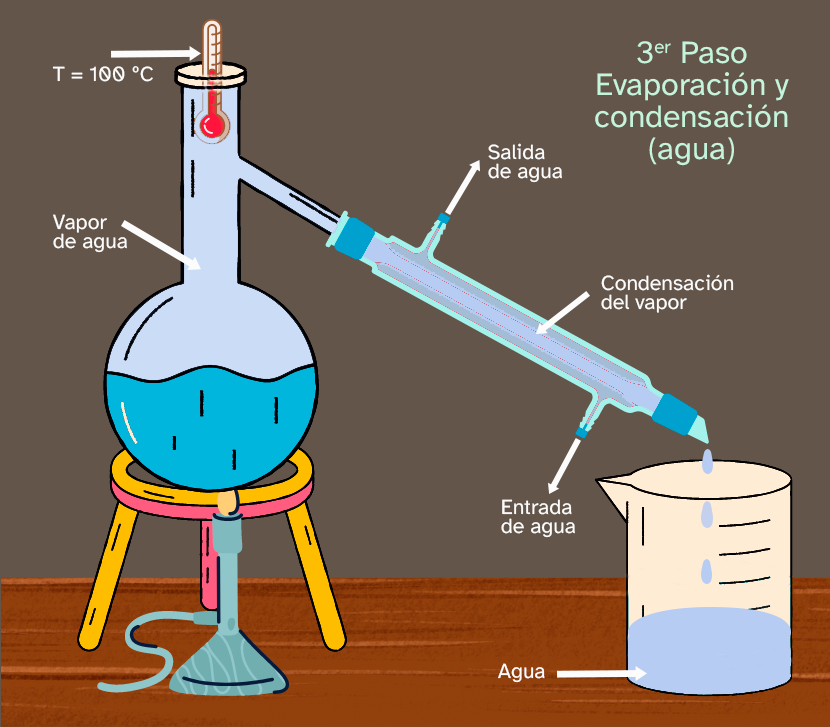
|
La secuencia es:
- Se calienta la mezcla en el matraz.
- El etanol tiene un punto de ebullición menor que el agua, por lo que se evapora el primero.
- El vapor de etanol puro es enfriado y condensa dentro del condensador Liebig, convirtiéndose en etanol puro líquido. Durante este proceso, el termómetro mostrará siempre el mismo valor de temperatura, que es precisamente el punto de ebullición del etanol puro.
- Cuando todo el etanol de la disolución haya sido evaporado, la temperatura empezará a aumentar de nuevo hasta alcanzar el valor del punto de ebullición del agua pura y será el agua la que comience a evaporar para ser separada.
Son líquidos que se pueden mezclar, dando lugar a una mezcla homogénea.
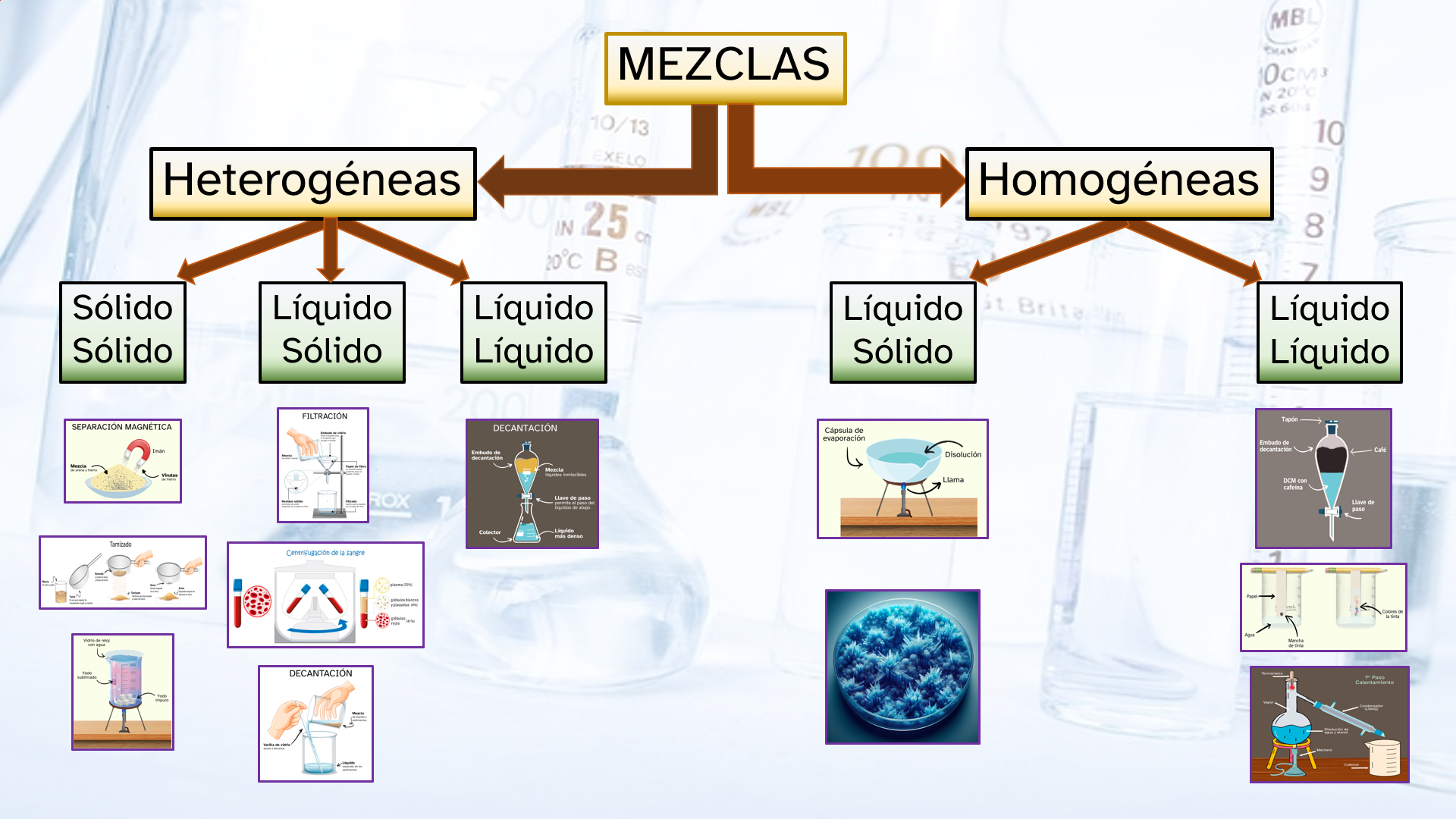
Esquema de ayuda
Puedes descargar el esquema que ves, a tamaño completo, si crees que te puede ser útil. Para ello, solo tienes que clicar en este enlace.
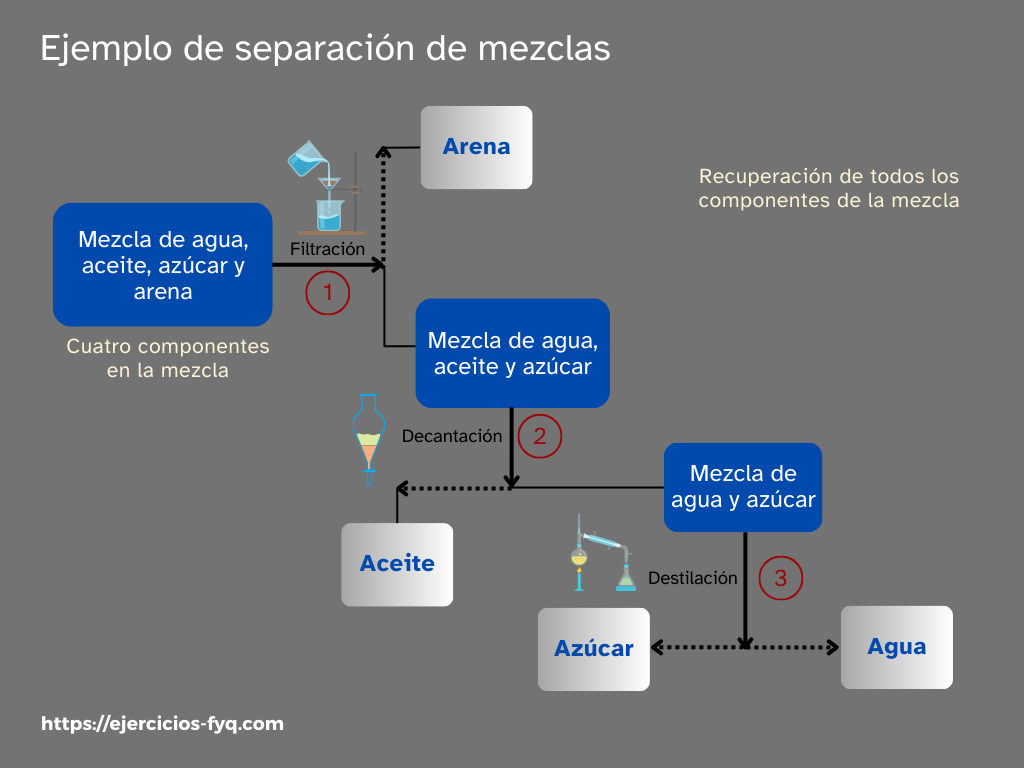
Ejemplo de separación de mezclas
En el siguiente esquema puedes ver cómo resolver una mezcla heterogénea de cuatro componentes. Es importante saber que dos de los componentes, el agua y el azúcar, forman entre sí una mezcla homogénea.
Casos prácticos
Primer caso
Explica cómo puedes separar los componentes de esta disolución:

Segundo caso
Tienes una mezcla de agua, arena, limaduras de hierro y sal de mesa. Describe cómo puedes separar cada uno de los componentes de la mezcla, indicando qué método aplicas y el resultado que obtienes después de cada paso.
Lo puedes hacer por evaporación o cristalización.
Un posible primer paso puede ser filtrar la mezcla para separar la fase líquida de la fase sólida. Se obtendría la arena y las limaduras de hierro en la fase sólida y una disolución de agua y sal en la fase líquida.
Intenta completar el resto de fases del ejercicio del mismo modo.
Obra publicada con Licencia Creative Commons Reconocimiento 4.0