Solubilidad
Solubilidad
Es extremadamente importante que recuerdes que las disoluciones son mezclas homogéneas. Esto significa que, por ejemplo, no podemos determinar la concentración de una mezcla de granos de arroz con agua porque, si mezclas ambos componentes, obtendrás una mezcla heterogénea en lugar de una disolución.
Estoy seguro de que alguna vez has echado azúcar a un vaso de agua o leche pero, ¿puedes disolver cualquier cantidad de azúcar en ese vaso de agua o leche? ¿Crees que hay una cantidad máxima de azúcar que podrás disolver?
Cuando nos referimos a disoluciones, debemos considerar la masa de soluto, la masa (o volumen) de disolvente y la temperatura. Hay una magnitud que da cuenta de estas tres variables: la solubilidad. Este curso vamos a usar la siguiente definición de solubilidad:
La cantidad de soluto que es posible disolver en 100 g de disolvente a una temperatura determinada
¿Cómo vamos a trabajar con la solubilidad?
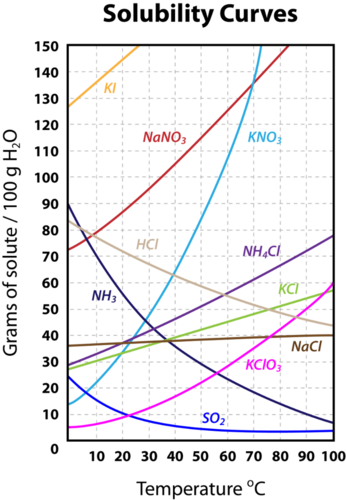
La solubilidad depende de varios factores como la naturaleza del soluto y del disolvente, la temperatura, la presión... Vamos a expresar la solubilidad de un soluto en determinado disolvente (siendo el agua el disolvente en la mayoría de los casos) referido a una masa de 100 g de disolvente. Si consideramos el agua como disolvente y representamos la variación de la solubilidad (solubility en inglés) de varios solutos con la temperatura, obtendremos un gráfico parecido a este:
Como puedes ver, el gráfico está representando la masa (gramos) de cada soluto que podemos disolver en 100 g de agua para distintos valores de temperatura.
La solubilidad de cada sustancia de la gráfica de arriba se determina experimentalmente disolviendo cantidades cada vez mayores de soluto en 100 g de agua, para cada valor de temperatura, hasta que no se puede disolver más soluto. Por ejemplo, aproximadamente 60 g of NH4Cl se pueden disolver a 70 ºC en 100 g de agua. Cuando se alcanza la máxima cantidad de soluto que se puede disolver, para una temperatura dada, en los 100 g de agua decimos que la disolución está saturada. Si seguimos añadiendo soluto, ya no será posible disolverlo y podremos distinguir dos fases en nuestro sistema, una parte líquida y otra sólida, dejando de ser una disolución; llamamos a esos sistemas disoluciones sobresaturadas.
Es una disolución en la que se ha disuelto la cantidad máxima de soluto que se puede disolver a una temperatura determinada.
Disolución en la que se ha sobrepasado la máxima cantidad de soluto que se puede disolver y quedan dos fases que son visibles: la fase líquida, que es la disolución saturada, y la fase sólida, que es el exceso de sal.
Vídeo-ejercicio
Mira el siguiente vídeo e indica si las siguientes conclusiones son verdaderas o falsas:
Retroalimentación
Verdadero
Retroalimentación
Verdadero
Retroalimentación
Falso
¿Cómo se lee una curva de solubilidad?
|
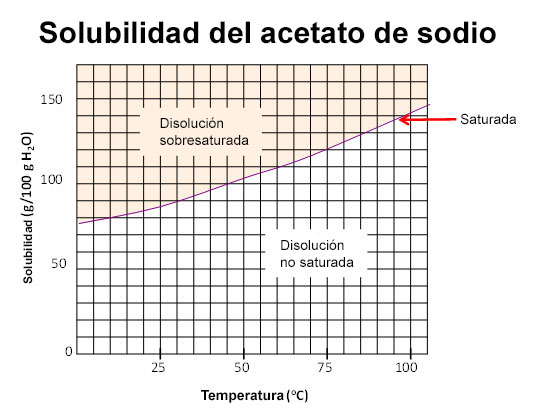
Esta imagen representa la curva de solubilidad del acetato de sodio (CH3COONa). La línea roja está dividiendo los estados de no saturación y sobresaturación de la disolución, pero, como puedes ver, esa línea depende de la temperatura. La curva roja está representando la saturación de la disolución. A 30 ºC puedes disolver 90 g de acetato de sodio como máximo. Si disuelves menos cantidad de esa sal, tendrás una disolución insaturada que puede ser diluida (si estás lejos de la línea roja) o concentrada (si te acercas más al valor de la línea roja). Si sobrepasas la cantidad de 90 g de soluto, la disolución final será sobresaturada, es decir, tendrás un sistema con dos fases; una disolución líquida y un exceso sólido de soluto. |
|
¿Cómo se construye una curva de solubilidad?
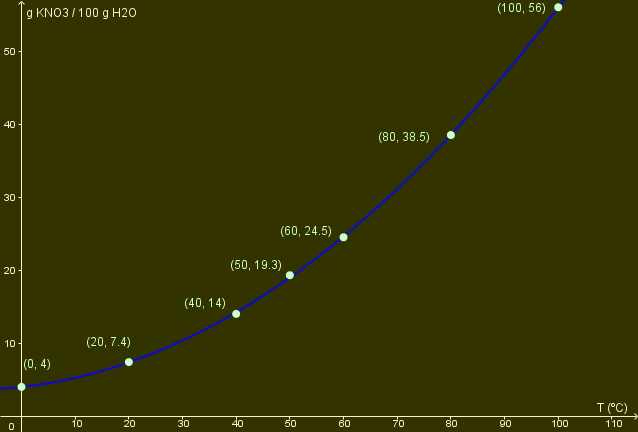
Solo puedes dibujar una gráfica cuando tienes un conjunto de datos sobre la solubilidad de una sustancia. Vamos a considerar datos del clorato de potasio (KClO3) como ejemplo. Si añadimos diferentes cantidades de esta sal a 100 g de agua a diferentes temperaturas, iremos obteniendo datos experimentales de solubilidad que podremos ordenar en una tabla de datos:
| Temperatura (ºC) | 0 | 20 | 40 | 50 | 60 | 80 | 100 |
| g KClO3 / 100 g H2O | 4.0 | 7.4 | 14.0 | 19.3 | 24.5 | 38.5 | 56.0 |
Ahora tienes que decidir cuál de las dos variables es la variable independiente. En este ejemplo, la temperatura es la variable independiente y es la que debes representar en el eje X, siendo la cantidad de soluto representada en el eje Y.
| Para representar la gráfica debes dibujar cada uno de los puntos que vienen dados por un par de datos en la tabla de datos. Quizás sería buena idea etiquetar los puntos, como puedes ver en la imagen. Después de hacerlo, conecta los puntos dibujando una línea. |
|
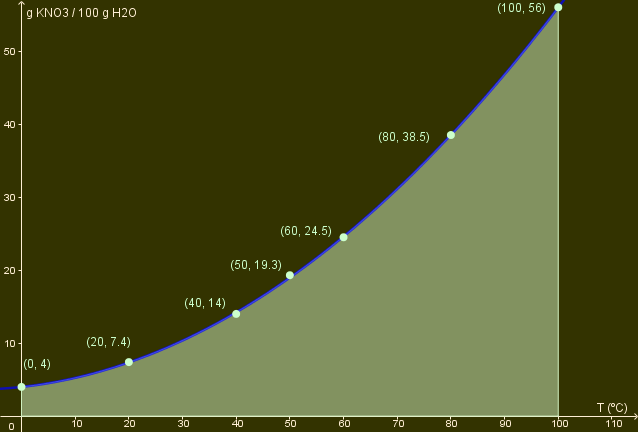
| Puedes rellenar el área de debajo de la línea, la parte inferior, para diferenciar claramente cada una de los tipos de disolución. El área superior representa la mezcla sobresaturada, mientras que la parte inferior (que está coloreada de verde) representa la disolución insaturada. Recuerda que la línea representa la disolución saturada. |
|
Ejercicios propuestos
Esta colección de ejercicios te ayudará a comprender esta parte y a preparar la próxima tarea de evaluación que harás.
Primer ejercicio
La solubilidad de una determinada sal a 25 ºC es de \(\textstyle{42\ g\over 100\ g\ \ce{H2O}}\). Calcula cuántos gramos de sal se pueden disolver en 450 g de agua.
Segundo ejercicio
Sobre una mesa de laboratorio hay tres frascos con la siguiente composición:
Frasco A. Contenido: 300 cm3 de agua con 15 g de sulfato de sodio.
Frasco B. Contenido: 100 cm3 de agua con 14 g de sulfato de sodio.
Frasco C. Contenido: 200 cm3 de agua con 38 g de sulfato de sodio.
Teniendo en cuenta que la solubilidad de la sal sulfato de sodio es \(s = 19\ \textstyle{g\ sal\over 100\ cm^3\ agua}\) , indica el tipo de disolución que contiene cada uno de los frascos:
a) El frasco A tiene en su interior una disolución: SATURADA - CONCENTRADA - DILUIDA
b) El frasco B tiene en su interior una disolución: SATURADA - CONCENTRADA - DILUIDA
c) El frasco C tiene en su interior una disolución: SATURADA - CONCENTRADA - DILUIDA
Tercer ejercicio
¿Cuántos gramos de nitrato de sodio podremos disolver en 0.25 L de agua a 30 ºC, sabiendo que la solubilidad de esta sal a la temperatura dada es \(s = \textstyle{95\ g\ \ce{NaNO3}\over 100\ g\ \ce{H2O}}\)?
Cuarto ejercicio
A partir de los datos del siguiente gráfico de solubilidades, y considerando que la densidad del agua es \(s = \textstyle{1\ g\over mL}\):
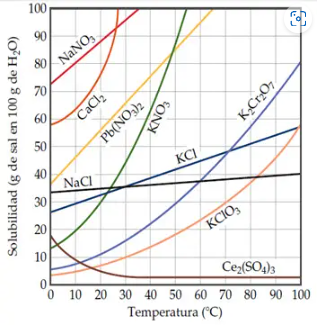
a) ¿Cuál es el mínimo volumen de agua necesario para disolver 40 gramos de nitrato de potasio, \(\ce{KNO3}\), a 30 ºC?
b) ¿Cuántos gramos de cloruro de sodio, \(\ce{NaCl}\), se deben disolver en 500 mL de agua para obtener una solución saturada a 10 ºC?
Quinto ejercicio
Analiza las siguientes curvas de solubilidad y responde a las siguientes preguntas:
a) Identifica la sustancia que es más soluble a 60 ºC.
b) Identifica la sustancia que es menos soluble a 40 ºC.
c) Identifica y establece las diferencias entre el sulfato de cerio, \(\ce{Ce2(SO4)3}\), y el nitrato de sodio \(\ce{NaNO3}\).
d) A una disolución acuosa de \(\ce{KNO3}\), a 20 ºC, se le agregó 50 g de dicha sal a 100 g de agua. ¿Qué pasará con el soluto extra? ¿Cuál es la cantidad de soluto extra que queda sin disolver?

Obra publicada con Licencia Creative Commons Reconocimiento 4.0