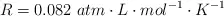-
Principio de Le Châtelier en un equilibrio heterogéneo (8207)
Si se introduce una cierta cantidad de 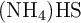 sólido en un recipiente cerrado y se calienta a
sólido en un recipiente cerrado y se calienta a 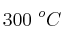 , se descompone estableciéndose el equilibrio:
, se descompone estableciéndose el equilibrio:
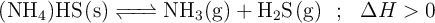
Con estos datos, razona sobre la veracidad o falsedad de las siguientes afirmaciones:
a) Cuando el volumen del recipiente se duplica, la cantidad de 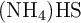 se reduce.
se reduce.
b) Cuando aumenta la temperatura disminuye la presión parcial de amoníaco.
c) El valor de la constante de equilibrio 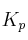 es independiente de la temperatura.
es independiente de la temperatura.
-
Aplicación del principio Le Châtelier y relación entre Kp y Kc (8206)
Para la reacción:

la constante de equilibrio de la reacción (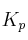 ) aumenta al aumentar la temperatura.
) aumenta al aumentar la temperatura.
a) Explica, de forma razonada, tres maneras de conseguir una reducción más eficiente del dióxido de estaño sólido.
b) ¿Qué relación existe entre 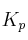 y
y 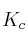 en este equilibrio?
en este equilibrio?
-
Moles de oxígeno para modificar la concentración de producto en un equilibrio (5331)
En un recipiente de 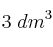 hay inicialmente 2 moles de dióxido de azufre gaseoso y 1 mol de trióxido de azufre gaseoso, a 700 K. Si se desea aumentar la concentración de trióxido de azufre hasta que llegue a 0.6 M:
hay inicialmente 2 moles de dióxido de azufre gaseoso y 1 mol de trióxido de azufre gaseoso, a 700 K. Si se desea aumentar la concentración de trióxido de azufre hasta que llegue a 0.6 M:
a) ¿Cuántos moles de oxígeno habrá que agregar al recipiente?
Considera el equilibrio y la constante  :
:
![\ce{SO2(g) + \textstyle{1\over 2}O2 (g) -> SO3(g)}\ \ [\ce{K_C = 18.9}] \ce{SO2(g) + \textstyle{1\over 2}O2 (g) -> SO3(g)}\ \ [\ce{K_C = 18.9}]](local/cache-TeX/b9b1e4c5bdf05810e5ce20c78100ce38.png)
-
EBAU Andalucía: química (junio 2023) - ejercicio C.2 (8038)
A 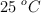 , la constante del producto de solubilidad del
, la constante del producto de solubilidad del 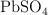 es
es 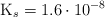 . Basándote en las reacciones químicas correspondientes, calcula:
. Basándote en las reacciones químicas correspondientes, calcula:
a) La solubilidad del 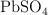 en agua a
en agua a 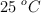 , expresada en
, expresada en 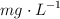 .
.
b) La masa de 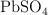 que se podrá disolver como máximo en 2 L de una disolución acuosa de
que se podrá disolver como máximo en 2 L de una disolución acuosa de 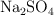 0.01 M, a
0.01 M, a 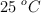 .
.
Datos: Pb = 207.2 ; S = 32 ; O = 16.
-
EBAU Andalucía: química (junio 2023) - ejercicio C.1 (8037)
Dado el siguiente equilibrio:
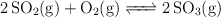
Se introducen 128 g de  y 64 g de
y 64 g de  en un recipiente cerrado de 2 L. Se calienta la mezcla y cuando se ha alcanzado el equilibrio, a
en un recipiente cerrado de 2 L. Se calienta la mezcla y cuando se ha alcanzado el equilibrio, a 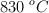 , ha reaccionado el
, ha reaccionado el 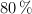 del
del  inicial. Calcula:
inicial. Calcula:
a) La composición en moles de la mezcla en el equilibrio y el valor de  .
.
b) La presión total de la mezcla en el equilibrio y el valor de  .
.
Datos: S = 32 ; O = 16 ;