Calcula la variación de la energía libre de Gibbs de la combustión del metano en condiciones estándar y decide si es un proceso espontáneo.
Datos: ![]() ;
; ![]() ;
; ![]() ;
; ![]()
Ejercicios y problemas de Termoquímica para 2.º de Bachillerato.
Calcula la variación de la energía libre de Gibbs de la combustión del metano en condiciones estándar y decide si es un proceso espontáneo.
Datos: ![]() ;
; ![]() ;
; ![]() ;
; ![]()
Calcula ![]() a 298 K para la reacción:
a 298 K para la reacción:
![]()
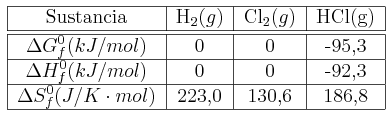
Calcula ![]() ,
, ![]() y
y ![]() e indica si es espontánea la siguiente reacción a 298 K:
e indica si es espontánea la siguiente reacción a 298 K:
![]()
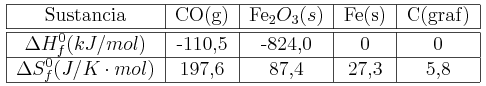
Calcula el incremento de energía libre estándar para las siguientes reacciones:
![]()
![]()
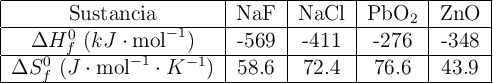
Comenta qué piensas sobre la posibilidad de utilizar estas reacciones en la obtención de flúor y plomo respectivamente. Datos:
La descomposición del monóxido de nitrógeno transcurre según:
![]()
Siendo ![]() y
y ![]() .
.
a) ¿Es la reacción espontánea en condiciones estándar?
b) ¿A partir de qué temperatura será espontánea?