-
PAU Andalucía: química (junio 2025) - ejercicio 5 (8492)
El deterioro como consecuencia de la oxidación es un gran problema económico para industrias que utilizan estructuras de hierro o de acero, sobre todo si se encuentran en ambientes húmedos o directamente en contacto con el agua, como plataformas sumergidas en el mar, tuberías subterráneas o cascos de barcos. En estos casos, la oxidación para formar óxido de hierro(III) es muy rápida y supondría grandes inversiones económicas tener que sustituir frecuentemente las partes oxidadas.
Una solución para evitar la oxidación del hierro y del acero es incorporar a la estructura piezas de otros metales que puedan formar con el hierro una pila galvánica en la que este sea el cátodo y el otro metal funcione como ánodo. A este método de protección se le llama «protección catódica» y a las piezas metálicas utilizadas para ello se les llama ánodos de sacrificio.
Uno de los metales más usados como ánodo de sacrificio es el magnesio, que puede obtenerse a partir del agua del mar, donde se encuentra disuelto en forma de 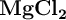 y de sulfato de magnesio. Una vez separado el
y de sulfato de magnesio. Una vez separado el 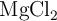 sólido, se procede a su electrolisis en estado fundido obteniéndose magnesio y cloro gaseoso.
sólido, se procede a su electrolisis en estado fundido obteniéndose magnesio y cloro gaseoso.
En la corteza terrestre también está presente el magnesio en forma de 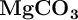 (
(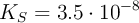 ), compuesto insoluble al igual que otras especies de este metal como el fosfato de magnesio (
), compuesto insoluble al igual que otras especies de este metal como el fosfato de magnesio (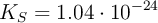 ), el
), el 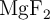 (
(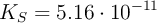 ) o el
) o el 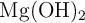 (
(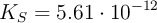 ).
).
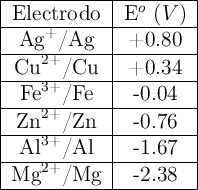
a) Justifica cuáles de los metales de la tabla pueden utilizarse como ánodo de sacrificio.
b) Calcula la intensidad de corriente necesaria para obtener una producción diaria de 10 kg de magnesio metálico por electrólisis de 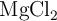 fundido, escribiendo la reacción correspondiente.
fundido, escribiendo la reacción correspondiente.
c) A partir del equilibrio de solubilidad del 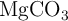 , determina la masa de magnesio que hay disuelta en 25 L de disolución saturada de dicha sal.
, determina la masa de magnesio que hay disuelta en 25 L de disolución saturada de dicha sal.
d) Nombra o formula los cuatro compuestos que aparecen en negrita en el texto.
Datos: 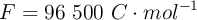 ; Mg = 24.3
; Mg = 24.3
-
EBAU Andalucía: química (junio 2024) - ejercicio C.4 (8277)
El 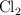 es un gas corrosivo por lo que se sintetiza en el laboratorio a través de la siguiente reacción:
es un gas corrosivo por lo que se sintetiza en el laboratorio a través de la siguiente reacción:
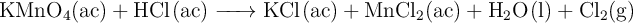
a) Ajusta las ecuaciones iónica y molecular por el método del ion-electrón.
b) Calcula el volumen de 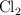 obtenido a
obtenido a 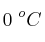 y 1 atm de presión a partir de 30 mL de una disolución 0.5 M de
y 1 atm de presión a partir de 30 mL de una disolución 0.5 M de 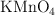 y 50 mL de una disolución 0.25 M de HCl.
y 50 mL de una disolución 0.25 M de HCl.
Dato: 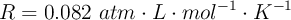
-
EBAU Andalucía: química (junio 2024) RESERVA - ejercicio C.4 (8245)
El níquel metálico reacciona con ácido nítrico concentrado según la reacción:
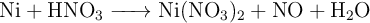
a) Ajusta las ecuaciones iónica y molecular por el método del ion-electrón.
b) Calcula la masa de níquel que podrá oxidarse con 1 mL de ácido nítrico comercial del 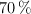 de riqueza en masa y densidad
de riqueza en masa y densidad 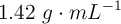 .
.
Datos: Ni = 58.7 ; N = 14 ; O = 16 ; H = 1.
-
EBAU Andalucía: química (junio 2023) - ejercicio C.4 (8043)
En una celda electrolítica que contiene 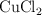 fundido se hace pasar una cierta cantidad de corriente durante 2 h, observándose que se deposita cobre metálico y se desprende dicloro. Basándote en las semirreacciones correspondientes:
fundido se hace pasar una cierta cantidad de corriente durante 2 h, observándose que se deposita cobre metálico y se desprende dicloro. Basándote en las semirreacciones correspondientes:
a) Determina la intensidad de corriente necesaria para depositar 15.9 g de Cu.
b) Calcula el volumen de 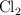 obtenido a
obtenido a 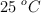 y 1 atm.
y 1 atm.
Datos: Cu = 63.5 ; 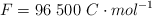 ;
; 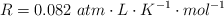 .
.
-
EBAU Andalucía: química (junio 2023) - ejercicio B.5 (8033)
Dados los siguientes potenciales de reducción: 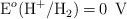 ;
; 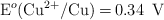 ;
; 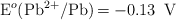 ;
; 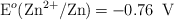 .
.
a) Explica, escribiendo las reacciones correspondientes, qué metal o metales producen desprendimiento de hidrógeno al ser tratados con un ácido.
b) Escribe las reacciones que tienen lugar en el ánodo y en el cátodo de la pila formada por los electrodos de Zn y Pb.
c) Escribe la notación de la pila formada por los electrodos del apartado b) y calcula su potencial.