-
Composición de una aleación que se hace reaccionar con ácido
Una aleación metálica de sodio y hierro(II) de 2.00 g de masa se trata con una cantidad suficiente de ácido clorhídrico, desprendiéndose 0.815 L de hidrógeno, medidos en condiciones normales. Calcula:
a) La composición porcentual en masa de aleación.
b) La masa sólida formada.
Na: 23 ; Fe = 56 ; H = 1.
-
Masa de alumnio impuro para reaccionar con una disolución dada
¿Qué masa de un aluminio comercial al 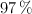 de riqueza es necesaria para la reacción completa con 100 mL de un ácido clohídrico comercial al
de riqueza es necesaria para la reacción completa con 100 mL de un ácido clohídrico comercial al 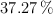 de pureza y densidad
de pureza y densidad 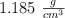 ?
?
Datos: H = 1 ; Cl = 35.5 ; Al = 27.
-
Velocidad de reacción en dos tubos de ensayo con distintas concentraciones
Se tienen dos tubos de ensayo en los que se agregan 3 mL de ácido sulfúrico al 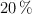 . En el primer tubo se deja caer una cinta de magnesio de 3 g y en el segundo tubo 3 g de cobre. Para culminar la reacción en el primer tubo transcurrieron 100 s y en el segundo tubo 300 s. ¿Cuál fue la velocidad de reacción para cada experiencia?
. En el primer tubo se deja caer una cinta de magnesio de 3 g y en el segundo tubo 3 g de cobre. Para culminar la reacción en el primer tubo transcurrieron 100 s y en el segundo tubo 300 s. ¿Cuál fue la velocidad de reacción para cada experiencia?
-
Reactivo limitante y masa de producto en la formación del KNO3 como fertilizante
El nitrato de potasio (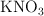 ) , muy usado como fertilizante, se obtiene a partir de la reacción entre el cloruro de potasio (
) , muy usado como fertilizante, se obtiene a partir de la reacción entre el cloruro de potasio (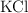 ) y el nitrato de sodio (
) y el nitrato de sodio (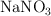 ) , obteniéndose además cloruro de sodio (
) , obteniéndose además cloruro de sodio (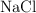 ). Si a 100 kg de
). Si a 100 kg de 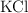 del
del 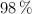 de riqueza se le agregan 400 L de disolución de
de riqueza se le agregan 400 L de disolución de 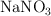 del
del 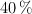 en masa y densidad
en masa y densidad 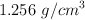 :
:
a) ¿Cuál es el reactivo limitante?
b) ¿Cuánto sobra del reactivo que está en exceso?
c) ¿Qué masa de 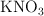 se ha obtenido si el rendimiento de la reacción es del
se ha obtenido si el rendimiento de la reacción es del 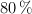 ?
?
Masas atómicas: K = 39 ; O = 16 ; N = 14 ; Cl = 35.5 ; Na =23.
-
Reactivo limitante y en exceso en la neutralización de HCl y NaOH (6520)
Se añaden 20 mL de ácido clorhídrico 8 M a un matraz que contiene 100 mL de una disolución de hidróxido de sodio 1.5 M, formándose cloruro de sodio y agua.
a) Escribe y ajusta la reacción.
b) Indicar cuál es el reactivo limitante y cuál está exceso.
c) Calcula la cantidad del reactivo en exceso que queda sin reaccionar.
Masas atómicas: H = 1 ; Cl =35.5