-
Aplicación del principio de Le Chatelier a la descomposición del N2O3
El trióxido de dinitrógeno se descompone en 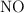 y
y 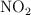 en el siguiente proceso endotérmico (
en el siguiente proceso endotérmico (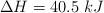 ):
):
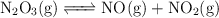
Predice cómo afectará el equilibrio cuando se produzcan los siguientes cambios:
a) Agregar más 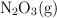 .
.
b) Agregar más 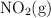 .
.
c) Aumentar el volumen.
d) Reducir la temperatura.
-
Análisis de la evolución del equilbrio de la descomposición del HI
En un recipiente de un litro de capacidad se introducen 0.4 moles de yoduro de hidrógeno, 0.2 moles de yodo y 0.1 moles de hidrógeno. La  para la descomposición del yoduro de hidrógeno ajustada a dos moles descompuestos, vale
para la descomposición del yoduro de hidrógeno ajustada a dos moles descompuestos, vale 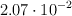 a una temperatura de 1 000 K.
a una temperatura de 1 000 K.
a) Discute que reacción se verá favorecida para que la reacción alcance el equilibrio.
b) Calcula el porcentaje que hay de cada gas en el equilibrio.
c) Si para el mismo equilibrio, inicialmente solo se hubiesen introducido 64 g de yoduro de hidrógeno, ¿qué tanto por ciento quedaría sin disociar una vez alcanzado el equilibrio? ¿Cuánto valdría el grado de disociación?
d) Discute y justifica la evolución del equilibrio si:
– Se disminuye la temperatura (la descomposición es exotérmica).
– Se añade yodo.
– Se añade al recipiente un gas noble (que no reacciona).
– Se añade un catalizador.
-
Masa de sal que cristaliza al cambiar la temperatura y producto de solubilidad (6454)
Disolvemos 2.5 g de clorato de potasio en 100 mL de agua a 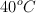 . Al enfriar a
. Al enfriar a 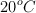 observamos que el volumen continuaba siendo de 100 mL pero se había producido la cristalización de parte de la sal. Sabiendo que la densidad del agua a
observamos que el volumen continuaba siendo de 100 mL pero se había producido la cristalización de parte de la sal. Sabiendo que la densidad del agua a 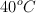 es de 0.9922 g/mL y la de la disolución del clorato de potasio a
es de 0.9922 g/mL y la de la disolución del clorato de potasio a 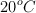 es de 1.0085 g/mL, calcula la masa de este compuesto que cristalizó. ¿Cuál es el producto de solubilidad del clorato de potasio a
es de 1.0085 g/mL, calcula la masa de este compuesto que cristalizó. ¿Cuál es el producto de solubilidad del clorato de potasio a 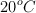 ?
?
-
Presión parcial del CO a la que es letal
La hemoglobina (Hb) puede formar un complejo con  o con
o con 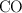 . Para la siguiente reacción, a temperatura corporal,
. Para la siguiente reacción, a temperatura corporal, 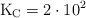 aproximadamente.
aproximadamente.

Cuando la relación ![\frac{[\ce{HbCO}]}{[\ce{HbO2}]} \frac{[\ce{HbCO}]}{[\ce{HbO2}]}](local/cache-TeX/3aab6fd7b82ea4d76fc01dd0b477bcb8.png) tiende a uno, la muerte es probable. ¿A qué presión parcial el
tiende a uno, la muerte es probable. ¿A qué presión parcial el 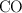 en el aire probablemente sea mortal? Asume que la presión parcial del
en el aire probablemente sea mortal? Asume que la presión parcial del  es 0.20 atm.
es 0.20 atm.
-
Presiones parciales y presión total en la descomposición del fosgeno
Para el equilibrio:
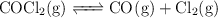
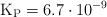 a determinada temperatura. Si al inicio la presión inicial del
a determinada temperatura. Si al inicio la presión inicial del 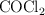 puro es 0.87 atm:
puro es 0.87 atm:
a) ¿Cuáles serán las presiones parciales en el equilibrio de 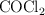 ,
, 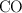 y
y 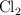 ?
?
b) ¿Cuál será la presión total en el equilibrio?